Электронные семейства - это понятие, которое используется в химии для описания распределения электронов в атомах и молекулах. Они являются основными строительными блоками, определяющими свойства и реактивность вещества.
Каждый атом состоит из электронных орбиталей, на которых находятся электроны. В электронных орбиталях электроны распределяются по энергетическим уровням и подуровням. Электронные семейства представляют собой группы электронов, находящиеся на одном энергетическом уровне и обладающие одинаковым спином.
Например, у атома водорода имеется одно электронное семейство, потому что на первом энергетическом уровне находится только одна орбиталь и один электрон.
Однако у сложных атомов, таких как углерод, атомно-орбитальная модель позволяет определить несколько электронных семейств. Например, у атома углерода на втором энергетическом уровне находятся две орбитали (2s и 2p) и 4 электрона. В этом случае, электроны распределяются по двум электронным семействам - спин ↑ в 2s-семействе и спин ↓ в 2p-семействе.
Знание о электронных семействах является фундаментальным для понимания строения атомов и молекул, а также для объяснения химических свойств веществ.
Определение электронных семейств

Например, первая энергетическая оболочка может содержать максимум 2 электрона, вторая - 8 электронов, третья - 18 электронов и так далее. Электроны располагаются в оболочках с более низкой энергией перед тем, как заполнить оболочки с более высокой энергией.
| Энергетическая оболочка | Максимальное количество электронов |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
Знание количества электронов в каждом энергетическом уровне позволяет понять, каким образом атом или ион установит связи с другими веществами и как будет происходить образование химических соединений.
Роль электронных семейств в атомах
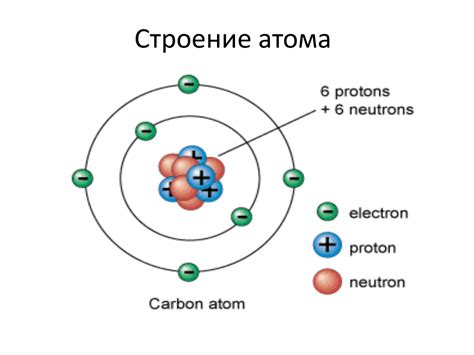
Электронные семейства или энергетические уровни представляют собой зоны вокруг атомного ядра, в которых находятся электроны. Все электроны в атоме располагаются на энергетических уровнях, которые могут быть разделены на подуровни и орбитали.
Электронные семейства играют важную роль в атомах. Они определяют множество атомных свойств, таких как размер атома, электроотрицательность, химическую активность и способность образовывать химические связи. Каждое электронное семейство может содержать определенное количество электронов, которое зависит от их энергии.
Наиболее близкие к ядру электроны располагаются на первом энергетическом уровне, который называется K-образным семейством. Он может содержать не более 2 электронов. Следующий уровень, L-образное семейство, может содержать до 8 электронов. Последующие энергетические уровни, M-, N-, O- и т. д., могут содержать все большее количество электронов.
| Энергетическое семейство | Максимальное количество электронов |
|---|---|
| K-образное семейство | 2 |
| L-образное семейство | 8 |
| M-образное семейство | 18 |
| N-образное семейство | 32 |
| O-образное семейство | 50 |
Правильное расположение электронов на энергетических уровнях влияет на химическую реактивность атома. Также важно отметить, что электроны внешнего энергетического семейства, называемого валентным семейством, имеют наибольшую энергию и играют наиболее активную роль в химических реакциях.
Взаимодействие электронных семейств

Взаимодействие электронных семейств может происходить по-разному в зависимости от типа взаимодействия. Одним из наиболее распространенных типов взаимодействия электронных семейств является образование химических связей. В результате обмена или совместного использования электронов между атомами, образуется связь, устанавливающаяся между ними. Часто связь сопровождается изменением энергии и стабилизацией образовавшейся молекулы или соединения.
Кроме образования связей, электронные семейства могут взаимодействовать через так называемые межмолекулярные силы, которые действуют между разными молекулами. Эти силы могут быть слабыми или сильными и могут влиять на различные свойства вещества, такие как температура кипения, растворимость и кондуктивность.
Один из примеров взаимодействия электронных семейств через межмолекулярные силы – это водородная связь. Водородная связь – это особый тип химической связи, возникающий между атомом водорода, присоединенным к электроотрицательному атому (например, азоту, кислороду или фтору), и электроотрицательным атому другой молекулы. Водородная связь является сильной и имеет важное значение для свойств воды, белков, нуклеиновых кислот и других биологических молекул.
Взаимодействие электронных семейств является основой многих процессов в природе и науке. Понимание этих взаимодействий позволяет увидеть внутренний мир микромасштабных объектов и предсказывать их свойства и поведение.