Атомная доля – это относительная масса атома элемента, выраженная в атомных массовых единицах (аму). Она показывает, сколько раз масса атома данного элемента больше массы атома углерода-12, взятой в качестве стандарта. Атомная доля является одной из основных величин в химии и физике, и она не зависит от количества атомов и молекул вещества.
Для определения атомной доли используется информация о массовом числе атома элемента и его архивном табличном значении – атомной массе. Массовое число – это сумма протонов и нейтронов в ядре атома, а атомная масса – это средняя масса атомов данного элемента, учитывая все изотопы и их относительные концентрации.
Когда мы говорим о массовом числе атома элемента, мы имеем в виду количество ядер, а не количество электронов, которое в атоме равно количеству протонов.
Для расчета атомной доли необходимо умножить отношение массы атома данного элемента к массе атома углерода-12 на одну атомную единицу массы (1 аму равна одной двенадцатой массы атома углерода-12).
Атомная доля играет важную роль в условиях изучения химических реакций и состава различных веществ. Она позволяет определить пропорции элементов в химических соединениях и использовать их для расчета массы и количества веществ, участвующих в реакциях и процессах. Благодаря атомной доле мы можем более точно изучать структуру веществ и их свойства, а также предсказывать и объяснять различные физические и химические явления.
Атомная доля: что это и как определить?
Определение атомной доли осуществляется путем расчета, используя формулу:
Атомная доля = (масса атомов данного элемента в соединении / общая молекулярная масса вещества) * 100%
Для расчета атомной доли необходимо знать массу атома данного элемента и общую молекулярную массу вещества, в котором присутствует данный элемент. Полученное значение атомной доли позволяет судить о присутствии и количестве данного элемента в химическом соединении.
Например, если молекулярная масса вещества составляет 100 г/моль, а масса атомов данного элемента в соединении - 20 г/моль, то атомная доля этого элемента будет равна:
Атомная доля = (20 г/моль / 100 г/моль) * 100% = 20%
Таким образом, атомная доля позволяет определить, какой процент данного элемента составляет вещество и является важным показателем при изучении химических соединений и состава вещества.
Определение и понятие атомной доли

Атомная доля может быть выражена в виде десятичной дроби или в процентном отношении. Например, атомная доля кислорода в воде (H2O) равна 11,2%, что означает, что в каждой молекуле воды присутствует около 11,2% атомов кислорода.
Определение атомной доли требует знания молекулярного состава соединения или смеси, а также молекулярной или атомной массы каждого элемента. Массовые доли каждого элемента в соединении или смеси могут быть вычислены с использованием формул и уравнений химических реакций.
Атомная доля играет важную роль в химических расчетах, таких как вычисление массы вещества, определение степени окисления элемента и расчет количества реагентов в химической реакции. Это также помогает химикам понять химические свойства вещества и его влияние на реакции и процессы.
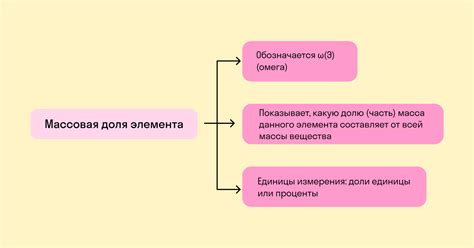
Формула для расчета атомной доли

Формула для расчета атомной доли (ω) задается следующим образом:
| Символы | Обозначения |
|---|---|
| Ni | число атомов элемента i |
| Nобщ | общее число атомов вещества |
Формула:
ω = (Ni / Nобщ) * 100%
Таким образом, чтобы рассчитать атомную долю элемента i, необходимо знать число атомов этого элемента (Ni) и общее число атомов вещества (Nобщ). Эти значения подставляются в формулу расчета атомной доли, после чего полученный результат умножается на 100% для получения процентного значения.
Важность и применение атомной доли

Атомная доля также играет роль в решении различных физических задач. Например, при расчете молярной массы вещества, атомные доли используются для определения массы каждого элемента и их вклада в общую массу вещества.
Кроме того, атомные доли могут быть использованы для определения количества реагентов, необходимых для реакции. Зная атомные доли элементов в реакции, мы можем вычислить стехиометрические коэффициенты и определить необходимое количество вещества для достижения желаемого результата.
Примеры расчета атомной доли
Для наглядности рассмотрим несколько примеров расчета атомной доли.
Пример 1:
Предположим, у нас есть молекула воды (H2O) и мы хотим найти атомные доли каждого элемента. Для этого нужно найти общую массу молекулы и разделить массу каждого атома на общую массу.
Молярная масса воды:
Масса водорода (H) = 1.007 г/моль
Масса кислорода (O) = 15.999 г/моль
Масса воды (H2O) = (2 * 1.007 г/моль) + (1 * 15.999 г/моль) = 18.015 г/моль
Теперь, чтобы найти атомную долю каждого элемента:
Атомная доля водорода (H) = (2 * 1.007 г/моль) / 18.015 г/моль = 0.1117, или 11.17%
Атомная доля кислорода (O) = (1 * 15.999 г/моль) / 18.015 г/моль = 0.8883, или 88.83%
Пример 2:
Предположим, у нас есть молекула ацетона (C3H6O) и мы хотим найти атомные доли каждого элемента.
Молярная масса ацетона:
Масса углерода (C) = 12.011 г/моль
Масса водорода (H) = 1.007 г/моль
Масса кислорода (O) = 15.999 г/моль
Масса ацетона (C3H6O) = (3 * 12.011 г/моль) + (6 * 1.007 г/моль) + (1 * 15.999 г/моль) = 58.080 г/моль
Теперь, чтобы найти атомную долю каждого элемента:
Атомная доля углерода (C) = (3 * 12.011 г/моль) / 58.080 г/моль = 0.5193, или 51.93%
Атомная доля водорода (H) = (6 * 1.007 г/моль) / 58.080 г/моль = 0.1039, или 10.39%
Атомная доля кислорода (O) = (1 * 15.999 г/моль) / 58.080 г/моль = 0.3768, или 37.68%
Таким образом, расчет атомной доли позволяет определить процентное содержание каждого элемента в молекуле. Это важное понятие в химии, которое помогает в понимании химических реакций и свойств веществ.
Связь атомной доли с химическими реакциями

С помощью атомной доли мы можем определить, какие элементы присутствуют в химической реакции и в каком количестве. Зная атомную долю элементов в реакционных веществах, мы можем вычислить их долю или массу в итоговых продуктах химической реакции.
Атомная доля позволяет установить соотношение между элементами в химическом соединении и предсказать реакционные возможности различных соединений. Например, зная атомную долю кислорода в воде (H2O), мы можем вычислить, сколько массы кислорода будет выделяться при разложении определенного количества воды.
Таким образом, атомная доля является важным понятием в химии, позволяющим предсказывать результаты химических реакций и определять количество элементов в соединениях. Она помогает разбираться в составе веществ и проводить расчеты в химических процессах.
Выводы

Атомная доля может быть определена с помощью химического анализа, который позволяет установить количество конкретного элемента в образце вещества. Также атомная доля может быть рассчитана с использованием данных о молярной массе элемента и массовой доле этого элемента в образце.
Знание атомной доли элементов позволяет проводить различные расчеты в химии, такие как расчеты молярных соотношений, составление химических формул, определение массовых долей элементов в соединениях и многие другие.