Изменение энтропии, меньшее нуля, является концепцией, которая часто вызывает путаницу и недоумение. В основе этого понятия лежит второй закон термодинамики, который утверждает, что энтропия вселенной всегда растет. Однако, существуют случаи, когда изменение энтропии может быть меньше нуля.
Когда изменение энтропии меньше нуля, это означает, что система упорядочивается или становится более организованной. Такие изменения нарушают общепринятую тенденцию к хаотичности, которую закон сохранения энергии и второй закон термодинамики привносят в системы.
Примером изменения энтропии, меньшей нуля, является образование кристаллов из расплава. При понижении температуры, молекулы вещества начинают упорядочиваться и образовывать регулярные структуры кристаллов. В этом случае, энтропия системы снижается, что противоречит общей тенденции увеличения энтропии.
Изменение энтропии, меньшее нуля, имеет важное применение в различных областях, включая химию, физику и биологию. Научное понимание и применение этого принципа позволяет объяснить и предсказать различные процессы и явления, в которых происходит упорядочивание системы.
Несмотря на то, что изменение энтропии, меньшее нуля, может сбивать с толку и вызывать вопросы, это явление строго соответствует законам термодинамики и играет важную роль в понимании и исследовании различных физических и химических процессов.
Что такое изменение энтропии

Энтропия имеет особое значение в термодинамике, где она связана с понятием необратимости процессов. В системе с низкой энтропией частицы упорядочены и движутся согласованно, в то время как в системе с высокой энтропией частицы расположены хаотично и движутся беспорядочно.
Если изменение энтропии меньше нуля, это означает, что система стала более упорядоченной. Например, если газ переходит из состояния с высокой энтропией (расширенное и разреженное состояние) в состояние с более низкой энтропией (сжатое состояние), то изменение энтропии будет отрицательным.
Изменение энтропии также может быть использовано для анализа процессов в других областях науки, таких как информатика, экономика и биология. Оно позволяет определить направление и характер изменений в системе и является важным инструментом для изучения различных процессов и явлений.
Определение понятия

Энтропия - физическая величина, которая характеризует степень хаоса или беспорядка в системе. В закрытой системе второго закона термодинамики обычно говорит о том, что энтропия всегда стремится увеличиваться, то есть система становится все более беспорядочной.
Однако возможностью измениться изменение энтропии также меньше нуля может происходить в особых условиях, например, при наличии внешнего воздействия или удалении энергии из системы. Такое изменение энтропии может приводить к обратимым или необратимым процессам, имеющим важное значение в различных областях науки и технологий.
Принцип изменения энтропии меньше нуля выполняется в различных областях, включая химию, физику и биологию. Он служит основой для понимания процессов, происходящих как в молекулярном масштабе, так и в масштабах великих систем. Этот принцип играет важную роль в разработке энергетических систем, оптимизации производства и научных исследованиях.
Теория энтропии
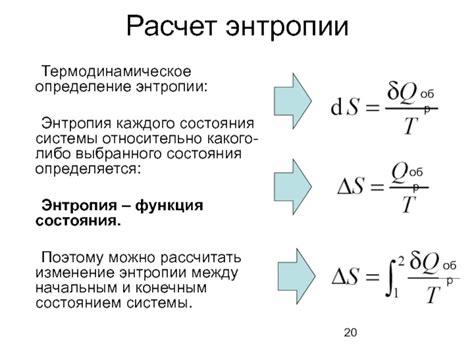
Энтропия обычно измеряется в джоулях на кельвин или в битах, и она может быть положительной или отрицательной величиной. Если изменение энтропии положительное, это означает, что система становится более хаотичной и неупорядоченной. Напротив, если изменение энтропии отрицательное, это означает, что система становится более упорядоченной и организованной.
Изменение энтропии, меньшее нуля, является особенным случаем. Согласно принципу второго закона термодинамики, который говорит о необратимости физических процессов, изменение энтропии системы всегда должно быть неотрицательным или равным нулю. Однако, существуют системы, для которых изменение энтропии может быть отрицательным. Такие системы нарушают классические представления о термодинамике и могут быть использованы в некоторых технологических приложениях.
Примером применения изменения энтропии, меньшего нуля, является технология холодильников и кондиционеров. В этих системах энтропия окружающей среды увеличивается за счет отбора тепла изнутри системы и его отвода наружу. Тем самым, система создает упорядоченность внутри, а окружающая среда становится менее упорядоченной. Это позволяет нам охлаждать температуру внутри помещений и сохранять продукты свежими.
Изменение энтропии меньше нуля

Изменение энтропии, меньшее нуля, означает уменьшение степени хаоса или беспорядка в системе. В научном сообществе это явление также называется "обратным изменением энтропии".
По определению, энтропия - это мера беспорядка или случайности в системе. Она характеризует количество доступных состояний системы и вероятность перехода из одного состояния в другое. Увеличение энтропии означает увеличение беспорядка, а уменьшение - уменьшение беспорядка.
Изменение энтропии меньше нуля может произойти в системах, где энергия переходит от внешней среды к системе и создает более упорядоченное состояние. Примером такой системы является холодильник, который отбирает тепло изнутри и передает его наружу, создавая более упорядоченное состояние холодильника внутри.
Другим примером является процесс конденсации, где газ переходит в жидкое состояние. В этом случае, уменьшение энтропии происходит из-за образования упорядоченной структуры молекул в жидкости.
Обратное изменение энтропии также может происходить в случае, когда система находится под воздействием внешних факторов, таких как сила или энергия. Например, в растущем кристалле энтропия снижается из-за процесса роста молекул в упорядоченную решетку.
Понимание изменения энтропии меньше нуля имеет широкий спектр применений в различных областях науки и техники. Оно позволяет прогнозировать и объяснять множество физических и химических процессов, на основе принципа сохранения энтропии.