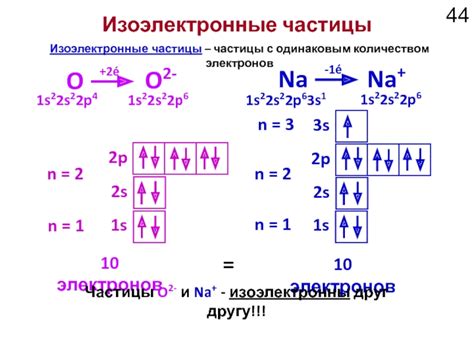
Изоэлектронные частицы – это атомы, ионы или молекулы, которые имеют одинаковое количество электронов. Такие частицы имеют одинаковую электронную конфигурацию и, следовательно, схожие свойства. Изоэлектронные частицы могут относиться к различным элементам или соединениям.
Изоэлектронные частицы имеют одинаковое количество электронов, но их ядра содержат разное количество протонов и нейтронов. Это объясняется различной атомной формулой каждой изоэлектронной частицы. Например, атом кислорода, ион оксида и молекула углекислого газа – все они имеют 8 электронов, но их атомные формулы различны: O, O2- и CO2.
Изоэлектронные частицы обладают свойствами, которые определяются количеством электронов. Например, электроны определяют реакционную активность и химическую устойчивость изоэлектронных частиц. Это значит, что если одна изоэлектронная частица обладает определенным химическим свойством, то другая частица с таким же количеством электронов также будет обладать этим свойством.
Пример изоэлектронных частиц – атомы ионов галогенов (фтора, хлора, брома, йода и астатина). Атомы этих элементов имеют одинаковое количество электронов, а их ядра содержат разное количество протонов и нейтронов. В результате, они обладают схожими химическими свойствами, такими как высокая реакционная активность и низкая устойчивость.
Изоэлектронные частицы: смысл и примеры
Примером изоэлектронных частиц могут служить ионы и атомы. Например, ион натрия Na+ и ион неона Ne имеют одинаковую конфигурацию электронов. Оба иона имеют 10 электронов, расположенных в двух электронных оболочках: первая оболочка содержит 2 электрона, а вторая оболочка содержит 8 электронов. Благодаря одинаковой конфигурации электронов у этих ионов, они обладают схожими свойствами.
Также, атомы различных химических элементов могут быть изоэлектронными. Например, атомы кислорода O и фтора F имеют одинаковую конфигурацию электронов. Оба атома имеют 8 электронов, расположенных в двух электронных оболочках. Поэтому они обладают похожими свойствами и могут образовывать схожие химические соединения.
| Частица | Конфигурация электронов |
|---|---|
| Ион натрия Na+ | 2, 8 |
| Ион неона Ne | 2, 8 |
| Атом кислорода O | 2, 6 |
| Атом фтора F | 2, 7 |
Всего лишь несколько электронов могут влиять на химические свойства частицы, поэтому изоэлектронные частицы схожи по своей реакционной способности.
Понятие изоэлектронности
Изоэлектронные частицы могут иметь разное ядерное зарядовое число и, соответственно, разное число протонов и нейтронов в ядре. Однако это не влияет на их электронную конфигурацию.
Изоэлектронность является важным понятием в химии, поскольку частицы с одинаковым электронным строением обладают сходными свойствами. Так, изоэлектронные ионы могут иметь одну и ту же структуру электронных оболочек, что делает их химически схожими и позволяет предсказывать и анализировать их реакционную активность.
Примерами изоэлектронных частиц являются ионы кислорода (O^2-), фтора (F^-) и нейтральные атомы неона (Ne), натрия (Na) и магния (Mg). Все они имеют аналогичную электронную конфигурацию с двумя электронами во внешней электронной оболочке.
| Частица | Электронная конфигурация |
|---|---|
| Ион кислорода (O^2-) | 1s^2 2s^2 2p^6 |
| Ион фтора (F^-) | 1s^2 2s^2 2p^6 |
| Атом неона (Ne) | 1s^2 2s^2 2p^6 |
| Атом натрия (Na) | 1s^2 2s^2 2p^6 3s^1 |
| Атом магния (Mg) | 1s^2 2s^2 2p^6 3s^2 |
Несмотря на различие в ядерном заряде, кислород, фтор, неон, натрий и магний обладают схожими химическими свойствами, так как их внешние электронные оболочки содержат одинаковое число электронов.
Какие элементы являются изоэлектронными

Наиболее распространенный пример изоэлектронных элементов - это инертные газы, такие как неон (Ne), аргон (Ar), криптон (Kr) и ксенон (Xe). Все они имеют полную валентную оболочку и стабильную электронную конфигурацию.
Некоторые другие изоэлектронные элементы включают серу (S), фосфор (P), хлор (Cl) и кальций (Ca). У этих элементов также есть полная валентная оболочка и схожие химические свойства.
Электронная конфигурация и изоэлектронность
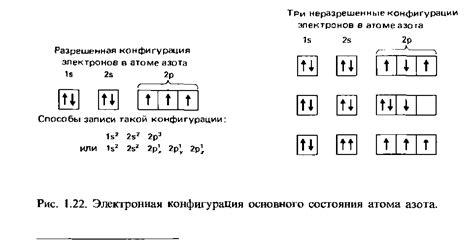
Электронная конфигурация описывает распределение электронов в атоме или ионе и определяет его химические свойства. Изоэлектронными называются различные атомы и ионы, которые имеют одинаковое количество электронов.
Изоэлектронные атомы и ионы имеют аналогичные внешние электронные оболочки, что делает их химически схожими и обладающими сходными свойствами.
Примеры изоэлектронных частиц:
| Частица | Электронная конфигурация |
|---|---|
| Неон (Ne) | 1s2 2s2 2p6 |
| Натрий (Na+) | 1s2 2s2 2p6 |
| Магний (Mg2+) | 1s2 2s2 2p6 |
| Кислород (O) | 1s2 2s2 2p4 |
| Фтор (F-) | 1s2 2s2 2p6 |
В приведенном примере газ неон (Ne), натрий (Na+) и магний (Mg2+) являются изоэлектронными частицами, так как у них одинаковая электронная конфигурация с внешней оболочкой 2s2 2p6. Кислород (O) и фтор (F-) также являются изоэлектронными частицами, так как у них одинаковая электронная конфигурация с внешней оболочкой 2s2 2p4.