Реакция сопропорционирования является одним из видов химических превращений, в которых два или более вещества образуют одно вещество, в то время как другие вещества превращаются вразнообразные соединения. В этом типе реакции происходит одновременное переходное вещества в более высокий или более низкий окислительный статус. Термин "сопропорционирование" обозначает процесс, при котором разные вещества соединяются и превращаются вещества с одинаковым окислительным статусом, или просто образуют вещества с одинаковым статусом.
Примером реакции сопропорционирования может служить реакция между оксидом серы (IV) и сероводородом. При взаимодействии этих двух веществ образуется сера и вода. Реакция имеет следующее уравнение:
SO2 + 2H2S -> 3S + 2H2O
В данном случае, оксид серы (IV) и сероводород сопропорционируются, исходя из того, что в оксиде серы (IV) атом серы имеет окислительный статус +4, а в сероводороде атом серы имеет окислительный статус -2. Молекулы серы, образовавшиеся как результат этой реакции, имеют окислительный статус 0, что является примером сопропорции - перехода на разные окислительные статусы веществ.
Определение реакции сопропорционирования в химии

Реакции сопропорционирования можно представить следующим уравнением:
А + В ⟶ С
Где А и В – различные вещества, которые окисляются и восстанавливаются соответственно, а С – новое вещество, образующееся в результате реакции.
Примером реакции сопропорционирования является реакция между хлоридом железа(II) и хлоридом железа(III). При взаимодействии этих веществ образуется хлорид железа(II,III), в котором железо находится в промежуточной степени окисления.
FeCl2 + FeCl3 ⟶ FeCl2,3
Реакция сопропорционирования широко используется в химическом синтезе и анализе для получения и исследования веществ с промежуточными степенями окисления. Также данная реакция является важным инструментом в решении различных задач во многих областях науки и промышленности.
Принципы реакции сопропорционирования

Принципы реакции сопропорционирования включают следующие особенности:
- Вещества, участвующие в реакции, должны иметь возможность принимать разные оксидационные состояния.
- Реакция происходит в химической системе, которая содержит как вещества, окисляющиеся, так и вещества, восстанавливающиеся.
- При реакции сопропорционирования восстанавливающееся вещество приводится к более высокому оксидационному состоянию, а окисляющееся вещество – к более низкому.
- Обычно вещества в реакции сопропорционирования встречаются в виде ионов, образующих сложные соединения.
Примеры реакций сопропорционирования включают:
- Реакцию сопропорционирования фосфора: 4P + 5O2 → 2P2O5
- Реакцию сопропорционирования марганца: MnO4- + 2Mn2+ + 4H+ → 3Mn3+ + 2H2O
Примеры реакции сопропорционирования

1. Сопропорционирование сероводорода (H2S):
3H2S + 4O2 → 2H2O + 3SO2
В этой реакции две молекулы сероводорода (H2S) реагируют с четырьмя молекулами кислорода (O2), чтобы образовать две молекулы воды (H2O) и три молекулы диоксида серы (SO2). В данном случае сер сопропорционируется из -2 степени окисления в +4 и -2.
2. Сопропорционирование хлора (Cl):
4Cl + 3O2 + 6H2O → 4HCl + 6HClO
В этой реакции четыре атома хлора (Cl) реагируют с тремя молекулами кислорода (O2) и шестью молекулами воды (H2O), чтобы образовать четыре молекулы соляной кислоты (HCl) и шесть молекул гипохлорита (HClO). Здесь хлор сопропорционируется из -1 степени окисления в -1 и +1.
3. Сопропорционирование оксида железа (Fe2O3):
4Fe2O3 + 3O2 → 6Fe3O4
В этой реакции четыре молекулы трехоксида железа (Fe2O3) реагируют с тремя молекулами кислорода (O2), чтобы образовать шесть молекул оксида железа (Fe3O4). Железо в данной реакции сопропорционируется из +3 и +2 степени окисления в +2 и +3.
Описанные примеры являются лишь некоторыми из множества реакций сопропорционирования, и они иллюстрируют различные химические соединения, подверженные этому типу реакции.
Реакция сопропорционирования между металлами
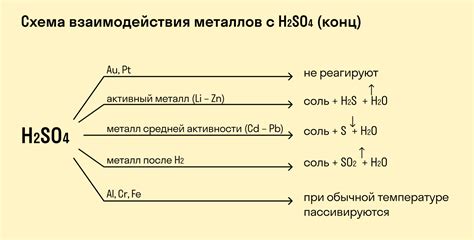
Примером реакции сопропорционирования между металлами является реакция между медью (Cu) и железом (Fe). В данной реакции медь, находящаяся в двух разных степенях окисления (+1 и +2), образует два продукта - медь(I) оксид (Cu2O) и медь(II) оксид (CuO). При этом железо, которое тоже находится в двух разных степенях окисления (+2 и +3), частично восстанавливается до степени +2. Итоговое уравнение реакции выглядит следующим образом:
| Реагенты | Продукты |
|---|---|
| 2Cu2O + Fe | 2CuO + FeO |
Реакция сопропорционирования между металлами находит применение в различных индустриальных процессах, а также в химическом анализе для определения концентрации металлов в смесях и растворах.
Реакция сопропорционирования в органической химии
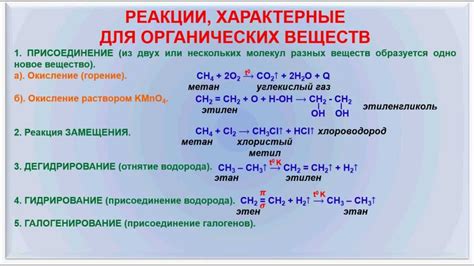
Одним из примеров реакции сопропорционирования является реакция бензойной кислоты с гидразином. В результате этой реакции бензойная кислота окисляется, а гидразин одновременно восстанавливается. В итоге образуется гидразобензол, содержащий атомы азота в кольце.
Формула реакции:
- C6H5COOH + N2H4 → C6H5NHNH2 + H2O
Другим примером реакции сопропорционирования является реакция двух молекул альдегида с образованием гемиацина. В ходе этой реакции один атом углерода из альдегида окисляется, а другой атом углерода одновременно восстанавливается. Образуется кетон, содержащий два карбонильных атома.
Формула реакции:
- 2RCHO → RCOCH2R + RCOOH
Реакции сопропорционирования широко применяются в органическом синтезе для получения ценных органических соединений с помощью комбинации окислительных и восстановительных процессов.
Важность реакции сопропорционирования

Одним из основных преимуществ реакции сопропорционирования является возможность получения чистых продуктов без использования дополнительных реагентов или катализаторов. При этом процесс сопропорционирования позволяет сократить количество отходов и улучшить экологические показатели производства.
Реакция сопропорционирования также играет важную роль в синтезе новых соединений и материалов. Некоторые из материалов, получаемых путем сопропорционирования, имеют уникальные свойства, которые делают их полезными для широкого спектра приложений. Например, титанаты можно использовать в качестве катализаторов, а перовскиты - в солнечных батареях.
Сопропорционирование также широко применяется в неорганической химии для управления окислительным состоянием атомов и ионов. Это позволяет контролировать свойства и характеристики соединений, обеспечивая более эффективное использование в различных областях науки и технологии.
В целом, реакция сопропорционирования представляет собой важный инструмент в химическом синтезе, который позволяет получать ценные продукты и контролировать химические свойства соединений. Этот процесс имеет широкие практические применения и активно исследуется в научных исследованиях и промышленности.
Реакция сопропорционирования: области применения

Один из примеров применения реакции сопропорционирования – получение пероксида водорода. При этом водород и кислород реагируют следующим образом:
2H2 + O2 → 2H2O2
В данном случае водород окисляется, а кислород одновременно восстанавливается до степени окисления -1. Получение пероксида водорода широко применяется в медицине, косметологии, пищевой промышленности и других областях.
Еще одной областью применения реакции сопропорционирования является синтез соединений между разными степенями окисления одного элемента. Например, в реакции сопропорционирования можно получить персульфаты, когда пероксид водорода реагирует с сульфатами:
H2O2 + 2SO4^2- → S2O8^2- + 2H2O
Персульфаты находят широкое применение в аналитической химии, производстве красителей и взрывчатых веществ.
Реакция сопропорционирования также применяется в синтезе органических соединений. Например, при сопропорционировании бромбензола можно получить гексафторциклогексан:
2C6H5Br + 3Br2 → (C6H5)3Br3
Этот соединение находит применение в органических синтезах и как компонент противопожарных добавок.
Таким образом, реакция сопропорционирования имеет широкие области применения, и ее использование может быть найдено в различных сферах химии и промышленности.