Наука о химических реакциях изучает взаимодействие атомов и молекул, которое определяет их свойства и радикально меняет мир вокруг нас. Электроотрицательность является важным понятием, связанным с химическими связями и взаимодействием атомов. Однако, в контексте химии, уменьшение электроотрицательности может иметь существенное влияние на химические реакции и их характеристики.
Электроотрицательность - это свойство атома притягивать электроны в химических связях. Стремление атома к электронам влечет за собой образование полярных связей или ионных связей. Высокая электроотрицательность атома означает, что он сильно притягивает электроны и образует стабильную связь с другим атомом или молекулой.
С другой стороны, уменьшение электроотрицательности атома означает, что он слабее притягивает электроны. Это может привести к изменению свойств химической связи и ее характеристик. Например, уменьшение электроотрицательности может способствовать образованию неполярных связей или слабых взаимодействий между атомами.
Электроотрицательность: основные понятия

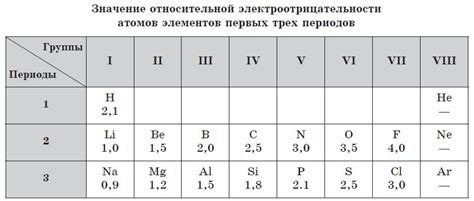
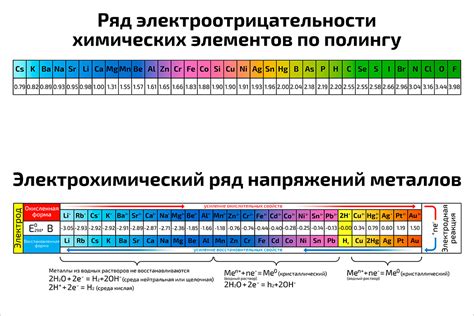
Самым электроотрицательным элементом является флуор, ему присваивается максимальное значение электроотрицательности, равное 4. Наоборот, солипсий обладает наименьшей электроотрицательностью, равной примерно 0.7. Электроотрицательность элементов стремится увеличиваться вдоль периодической системы и уменьшаться вдоль группы.
Значение электроотрицательности вещества определяется через разность электроотрицательностей атомов или молекул, образующих химическую связь. Если разность электроотрицательностей большая, то связь считается полярной, то есть существует перемещение электронов от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Если разность электроотрицательностей мала или равна нулю, то связь считается неполярной.
| Элемент | Электроотрицательность |
|---|---|
| Флуор | 4.0 |
| Кислород | 3.5 |
| Азот | 3.0 |
| Водород | 2.2 |
| Солипсий | 0.7 |
Знание электроотрицательности элементов позволяет предсказывать химическую активность веществ и направленность химических реакций. Например, водород с низкой электроотрицательностью образует положительные ионы, а флуор с высокой электроотрицательностью образует отрицательные ионы. Электроотрицательность влияет на растворимость веществ, способность образовывать ковалентные и ионные связи, а также на свойства молекул и соединений в целом.
Электроотрицательность в химической связи
В химической связи участвуют атомы, в результате взаимодействия которых образуется молекула. Электроотрицательность атомов влияет на характер связи и ее полярность. Если значения электроотрицательности участвующих атомов различны, то образуется полярная связь.
Полярная связь образуется между атомами, у которых различные электроотрицательности. В этом случае электроны будут смещаться в сторону более электроотрицательного атома, создавая электрический диполь. Это может привести к созданию дополнительных сил в молекуле, таких как ван-дер-ваальсовы силы или диполь-дипольные взаимодействия.
Электроотрицательность влияет не только на связь между атомами, но и на химические реакции. Взаимодействие различных веществ происходит с учетом их электроотрицательности. Атомы с высокой электроотрицательностью обычно обладают большей активностью в химических реакциях и могут образовывать ионы или вступать в обмен электронами.
Оценка электроотрицательности атомов позволяет прогнозировать свойства соединений и предсказывать результаты химических реакций. Электроотрицательность - это важный параметр в химии, который помогает понять и объяснить различные аспекты химической связи и реакций.
Уменьшение электроотрицательности: причины и механизмы

Уменьшение электроотрицательности может происходить по ряду причин и механизмов:
- Добавление внешних электронов: при добавлении внешних электронов к атому, он становится более отрицательно заряженным и его электроотрицательность снижается.
- Ионизация: ионизация атома, то есть его переход из нейтрального состояния в ионное, может также уменьшить его электроотрицательность.
- Структурные изменения: определенные структурные изменения атома, такие как изменение геометрии или замещение атомов, могут привести к снижению его электроотрицательности.
- Эффекты соседних атомов: электроотрицательность атома может быть снижена влиянием соседних атомов, которые притягивают электроны сильнее.
Уменьшение электроотрицательности атома имеет важные последствия для химических реакций. Это может способствовать образованию связей между атомами с разными электроотрицательностями, что облегчает образование многих соединений.
Влияние уменьшения электроотрицательности на связь

Уменьшение электроотрицательности атома может иметь значительные последствия для химических связей. Во-первых, снижение электроотрицательности повышает вероятность образования ионной связи. В ионной связи один атом с большей электроотрицательностью забирает электроны у атома с меньшей электроотрицательностью, образуя положительный и отрицательный ионы.
Кроме того, уменьшение электроотрицательности может способствовать образованию ковалентной связи. В ковалентной связи электроны между атомами разделяются равномерно, и электроотрицательность не играет такую существенную роль. Если атомы имеют сходные электроотрицательности или электроотрицательность одного атома намного ниже, чем у другого атома, то возникает ковалентная связь.
Таким образом, уменьшение электроотрицательности атома может изменять тип связи в химической реакции. Это может влиять на множество химических процессов, включая степень реакции, скорость реакции и образование продуктов реакции.
Электроотрицательность и положительные ионы
При уменьшении электроотрицательности атома возрастает его способность отдавать электроны другим атомам, что приводит к образованию катионов. Катионы имеют положительный заряд и образуются, когда атом теряет один или несколько электронов. Количество электронов, которые теряет атом при образовании катиона, зависит от его электроотрицательности.
Положительно заряженные ионы играют важную роль в химических реакциях. Они могут образовывать ионы, соединяться с отрицательно заряженными атомами или молекулами, образуя стабильные химические соединения. Катионы также могут быть вовлечены в электрохимические процессы, такие как электролиз и гальванические элементы.
Изменение электроотрицательности в химической реакции может привести к изменению поведения атомов и молекул. Уменьшение электроотрицательности атома может способствовать его активной реакции с другими веществами и участию в различных биохимических и физиологических процессах.
Примеры химических элементов с уменьшенной электроотрицательностью
Уменьшение электроотрицательности элемента может быть важным фактором при изучении химических реакций. Некоторые элементы имеют низкую электроотрицательность, что делает их менее склонными к привлечению электронов во внешней оболочке. Вот несколько примеров элементов с уменьшенной электроотрицательностью:
- Гелий (He) - Гелий является инертным элементом и его электроотрицательность близка к нулю. Он практически не образует химических соединений.
- Неон (Ne) - Неон также относится к инертным газам и имеет низкую электроотрицательность. Он используется в различных светоизлучающих приборах.
- Аргон (Ar) - Аргон также является инертным газом и имеет низкую электроотрицательность. Он используется в заполнении ламп накаливания и защите сварщиков от вредных газов.
- Серебро (Ag) - Серебро имеет низкую электроотрицательность и определяет его превосходные свойства в ювелирной и фотографической индустриях.
- Медь (Cu) - Медь также имеет низкую электроотрицательность и широко используется в электротехнике и строительстве.
Эти элементы обладают уникальными свойствами, обусловленными их уменьшенной электроотрицательностью. Изучение химии этих элементов позволяет лучше понять их поведение в различных химических реакциях и применениях.
Увеличение реакционной активности при уменьшении электроотрицательности
Уменьшение электроотрицательности элемента отражает его способность притягивать электроны, когда он участвует в химической реакции. Это свойство оказывает влияние на химическую активность элементов и их реакционную способность.
При уменьшении электроотрицательности элемента, его способность притягивать электроны снижается. Это означает, что элемент становится более склонным отдавать электроны другим элементам и формировать положительные ионы. Таким образом, уменьшение электроотрицательности приводит к повышению реакционной активности элемента и его способности участвовать в различных химических реакциях.
Увеличение реакционной активности при уменьшении электроотрицательности может иметь следующие эффекты:
- Увеличение скорости реакции: Более реакционно-активные элементы, имеющие низкую электроотрицательность, реагируют быстрее с другими элементами и соединениями.
- Увеличение вероятности реакции: Более реакционно-активные элементы имеют большую вероятность участвовать в реакциях и образовании новых соединений.
- Изменение типа реакций: Снижение электроотрицательности может привести к изменению типа реакции, которую элемент может осуществить. Например, элемент с высокой электроотрицательностью может быть способен только к реакции окисления, в то время как элементы с низкой электроотрицательностью могут претерпевать и другие типы реакций.
В целом, уменьшение электроотрицательности может привести к увеличению реакционной активности элемента, что позволяет ему участвовать в более широком спектре химических реакций и формировать разнообразные соединения.
Уменьшение электроотрицательности и положительное окисление

Уменьшение электроотрицательности элемента обозначает его способность меньше притягивать электроны к себе в химических реакциях. Это явление может оказывать значительное влияние на реакционную способность элемента и его возможность проявлять положительное окисление.
Положительное окисление означает, что элемент теряет электроны в химической реакции. Такое состояние может быть связано с изменением числа валентных электронов элемента. Уменьшение электроотрицательности может способствовать положительному окислению, так как элемент с меньшей электроотрицательностью будет менее заинтересован в притяжении электронов и более склонен отдавать их другим элементам.
Положительное окисление имеет важное значение при реакциях окисления и восстановления. Окислительные реакции происходят, когда один элемент увеличивает свою положительную окислительную степень или теряет электроны. Восстановительные реакции, напротив, происходят, когда элемент уменьшает свою окислительную степень или приобретает электроны.
Уменьшение электроотрицательности элемента может изменить его способность быть окислителем или восстановителем в реакциях и, таким образом, влиять на тип и скорость химических превращений. Определение электроотрицательности элементов и понимание ее значимости позволяет более точно предсказывать и объяснять процессы, происходящие в химических системах.
Гибридизация и уменьшение электроотрицательности

Уменьшение электроотрицательности происходит в результате образования гибридных орбиталей, которые позволяют атому эффективнее участвовать в химических реакциях и образовывать связи с другими атомами.
Гибридизация может происходить в разных формах: sp, sp2 и sp3. В случае гибридизации sp, атом образует две гибридные орбитали и имеет линейную форму, что приводит к уменьшению электроотрицательности атома. Гибридизация sp2 происходит, когда атом образует три гибридные орбитали и имеет плоскую треугольную схему. Гибридизация sp3 происходит, когда атом образует четыре гибридные орбитали и имеет пирамидальную или тетраэдрическую форму.
Уменьшение электроотрицательности атома в результате гибридизации позволяет ему образовывать более слабые связи и быть более реактивным в химических реакциях. Это имеет важное значение, так как связи между атомами в молекуле определяют ее химические свойства и возможность участия в реакциях.
Практическое применение уменьшения электроотрицательности

Уменьшение электроотрицательности химического элемента может иметь различные практические применения в разных областях науки и промышленности.
В области катализа, элементы с низкой электроотрицательностью могут быть использованы для создания эффективных катализаторов. Это связано с тем, что элементы с низкой электроотрицательностью имеют большую способность принимать электроны и участвовать в химических реакциях. Такие катализаторы могут использоваться, например, для ускорения реакций в промышленности или для создания более эффективных энергетических систем.
В области материаловедения, уменьшение электроотрицательности элементов может приводить к изменению их физических и химических свойств. Например, дополнение материала элементами с низкой электроотрицательностью может улучшить его проводимость, повысить его термическую стабильность или изменить его магнитные свойства. Это может быть важным в процессе создания новых материалов с определенными свойствами, таких как полупроводники, магнитные материалы или материалы с высокой температурной стабильностью.
В химической промышленности, уменьшение электроотрицательности может играть роль при разработке новых методов синтеза химических соединений. Это связано с тем, что элементы с низкой электроотрицательностью могут образовывать более стабильные соединения и проходить химические реакции с меньшими энергетическими затратами. Это может сильно сократить затраты на процессы синтеза и повысить их эффективность.
Кроме того, уменьшение электроотрицательности может использоваться и в других областях, таких как фармацевтика, энергетика, экология и многое другое. Например, в фармацевтической промышленности элементы с низкой электроотрицательностью могут использоваться для создания биологически активных соединений или для разработки новых лекарственных препаратов с подобранными свойствами.
В целом, практическое применение уменьшения электроотрицательности имеет широкий спектр возможностей и может быть использовано для создания новых материалов, улучшения процессов производства и разработки новых технологий в различных сферах науки и промышленности.