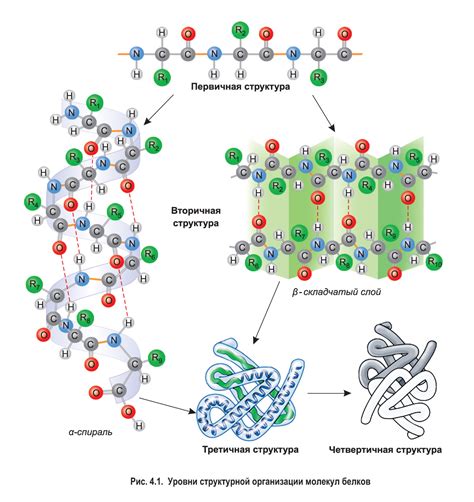
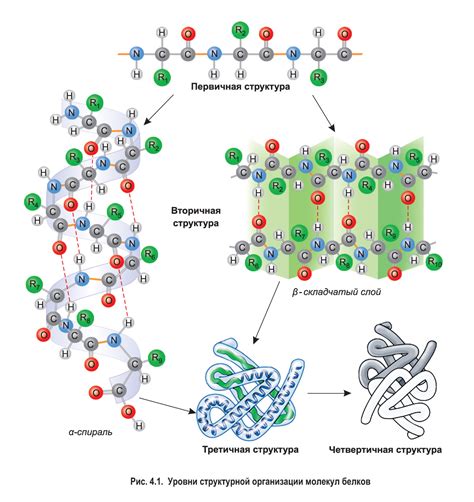
Вторичная структура белка является одним из уровней его организации и играет важную роль в его функционировании. Она описывает пространственное расположение аминокислотных остатков внутри полипептидной цепи. Вторичная структура образуется благодаря взаимодействию главной цепи белка и может принимать различные формы, такие как спираль, листовидный склад или некоторые комбинации.
Основной строительный блок вторичной структуры белка - это α-спираль или β-складка. α-спираль представляет собой спиральную форму, в которой главная цепь белка сворачивается вокруг воображаемой оси, образуя хелекс. β-складка представляет собой развернутую форму, в которой главная цепь белка сворачивается в плоскости и перекрывает себя.
Вторичная структура белка образуется благодаря взаимодействию водородных связей между аминокислотными остатками. Водородные связи возникают между донорными атрибутами (NH) главной цепи белка и акцепторными атрибутами (CO) того же белка или других белков. Это взаимодействие обеспечивает стабильность вторичной структуры и позволяет белкам выполнять свои функции в организмах.
Вторичная структура белка имеет большое значение, поскольку она определяет его физические и химические свойства. Она также оказывает влияние на дальнейшее уровневую организацию белка и его функционирование. Понимание вторичной структуры также является важной запятой в нашем стремлении использовать белки в различных областях, включая медицину, фармацевтику и биотехнологию.
Белок и его вторичная структура
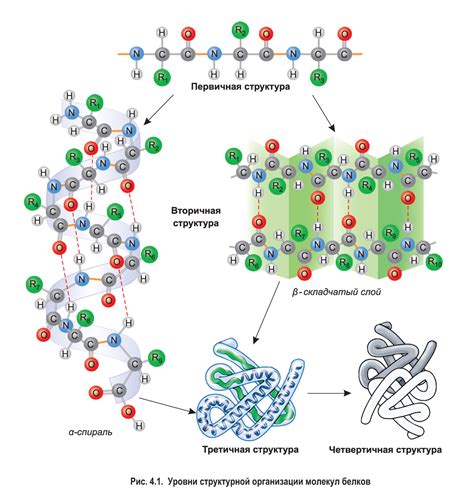
Вторичная структура белка представляет собой упорядоченное пространственное расположение аминокислот, которое возникает в результате взаимодействия белковой цепи с самой собой. Она определяет пространственную архитектуру белка и играет важную роль в его функционировании.
Одной из основных форм вторичной структуры белка является альфа-спираль. Она представляет собой спиральную витую цепочку, в которой каждый остаток аминокислоты связан с двумя соседними остатками. Эта структура образуется за счет водородных связей между оксигеном одного остатка аминокислоты и атомом азота другого остатка.
Вторичная структура также может представлять собой бета-складку, которая образуется при взаимодействии параллельных или антипараллельных полос бета-листа. Эти полосы связаны водородными связями, образуя строение, напоминающее складку.
Основные факторы, которые определяют формирование вторичной структуры белка, включают последовательность аминокислот, физико-химические свойства остатков, а также окружение и условия среды. Вторичная структура может также служить основой для формирования третичной и кватернической структуры белка.
Выводы:
- Вторичная структура белка - это упорядоченное пространственное расположение аминокислот в белковой цепи.
- Альфа-спираль и бета-складка являются основными формами вторичной структуры белка.
- Факторы, влияющие на формирование вторичной структуры, включают последовательность аминокислот, физико-химические свойства остатков и условия среды.
Что такое вторичная структура белка
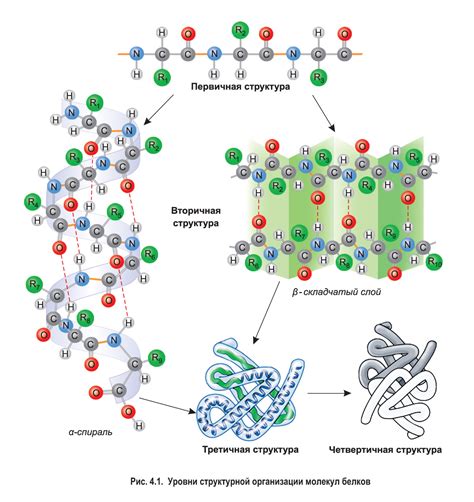
Вторичная структура белка относится к одному из уровней организации пространственной структуры белков. Она описывает регулярные пространственные узоры, которые образуются благодаря взаимодействию аминокислотных остатков в цепи белка.
Основные типы вторичной структуры белка включают α-спираль и β-складку. Аминокислотные остатки в цепи белка соединяются в пространственные узоры, которые могут быть прямолинейными или изогнутыми.
α-спираль представляет собой спиральную структуру, образованную связыванием противоположных аминокислотных остатков в цепи белка. Она характеризуется тем, что каждый аминокислотный остаток образует взаимодействия с остатками, расположенными непосредственно перед и после него в цепи.
β-складка представляет собой структуру, состоящую из нескольких параллельных или антипараллельных цепочек. Аминокислотные остатки в цепи соединяются таким образом, что образуются разнообразные пространственные узоры.
Вторичная структура белка является важным элементом для его функционирования. Она обеспечивает стабильность белка, позволяет формировать устойчивые связи между аминокислотными остатками и способствует правильному сворачиванию белковой цепи.
Виды вторичной структуры белка
Наиболее распространенными видами вторичной структуры белка являются альфа-спираль (α-спираль) и бета-складка (β-складка).
Альфа-спираль представляет собой спиральную конформацию полипептидной цепи, в которой пептидные связи скручиваются вокруг центральной оси. Возникающая пространственная структура обладает высокой стабильностью и позволяет белку обладать определенными физико-химическими свойствами.
Бета-складка представляет собой параллельное или антипараллельное расположение смежных участков полипептидной цепи. В этом случае пептидные связи ориентированы перпендикулярно оси молекулы. Сопряжение бета-компонентов создает структурные элементы, называемые бета-листы. Бета-складка является важным элементом вторичной структуры белка, так как формирует основу для создания третичной структуры.
Другими видами вторичной структуры белка являются транс-меры, характеризующиеся надмолекулярными взаимодействиями, такими как множественные водородные связи между различными участками полипептидной цепи.
Альфа-спираль
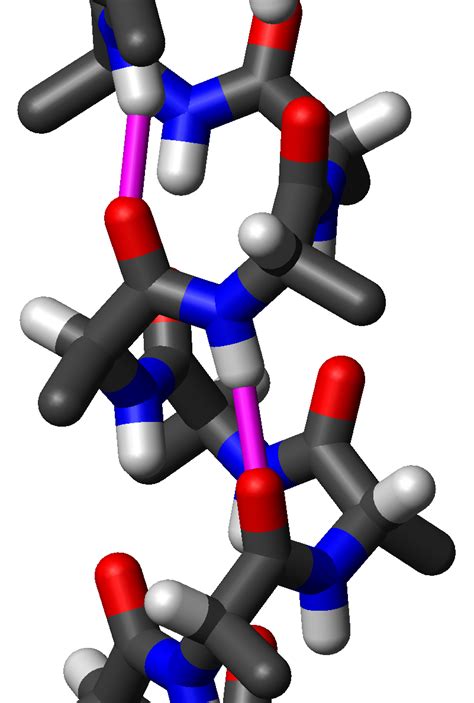
Спираль образуется благодаря взаимодействию водородных связей между аминокислотными остатками. На каждом шаге спирали имеется три аминокислотных остатка, которые связываются между собой и создают стабильное пространственное строение.
Альфа-спираль обладает рядом важных свойств. Во-первых, она обеспечивает устойчивость белка, так как взаимодействие аминокислотных остатков создает пространственную структуру, которая неспособна с легкостью изменяться. Во-вторых, альфа-спираль является доступной для взаимодействия с другими белками и молекулами, так как наружу спирали обращены гидрофильные остатки, которые способны взаимодействовать с водой и другими молекулами.
В целом, альфа-спираль является важным элементом вторичной структуры белка. Она обеспечивает его функциональность и стабильность, а также позволяет взаимодействовать с другими молекулами. Понимание формирования и свойств альфа-спирали помогает исследователям лучше понимать биологические процессы, связанные с белками, и может иметь значительное практическое применение в различных областях, например, в разработке новых лекарственных препаратов и биотехнологических продуктов.
Бета-складка
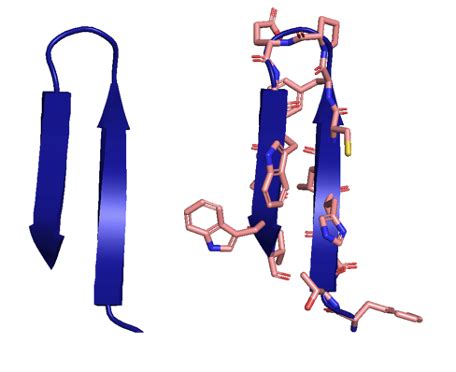
Бета-складка формируется благодаря водородным связям между аминокислотными остатками в белке. В результате образуются параллельные или антипараллельные либо смешанные странды, которые связаны друг с другом. Такое связывание происходит благодаря формированию углеводородных связей между атомами водорода и азота, которые находятся на разных страндах.
Бета-складка может принимать различные формы и конфигурации, включая бета-баррели и бета-косички. Эти структуры часто встречаются в мембранных белках и играют важную роль в их функциональности. Бета-складка также является одной из основных структур, образующих белковые домены, которые выполняют разнообразные функции в клетке.
Понимание бета-складки и ее формирования является важным для изучения структуры и функции белка. Исследования в этой области помогают расширить наши знания о биологических процессах и разработке лекарственных препаратов, связанных с белками.
Петля

Петля имеет гибкую и подвижную структуру, что позволяет ей совершать различные движения в пространстве. Это важно для функционирования белка, так как петли могут участвовать в связывании с другими молекулами или взаимодействии с другими элементами белковой структуры.
Формирование петли происходит за счет различных типов связей между аминокислотами. Внутри петли могут быть образованы водородные связи, гидрофобные взаимодействия и электростатические взаимодействия. Это позволяет петле принимать определенную конформацию и обеспечивает ее стабильность.
Петли могут быть разными по длине и структуре. Они могут образовывать повороты, петли или спирали, в зависимости от типовых взаимодействий между аминокислотами.
Изучение петель вторичной структуры белка позволяет понять их роль в функционировании белка и может быть полезно для разработки новых методов лечения различных заболеваний, включая рак и инфекционные болезни.
Характерные особенности вторичной структуры
Основными типами вторичной структуры белка являются α-спираль и β-складка. Они обладают рядом характерных особенностей, которые определяют их свойства и функции:
- α-спираль: образуется за счет связывания водородных связей между соседними аминокислотными остатками. Характерная особенность α-спирали - прямая аксисстема и регулярная поворотность цепочки.
- β-складка: образуется благодаря расположению параллельных или антипараллельных цепочек, которые связываются водородными связями. Характеристической особенностью β-складки является разделение цепочки на плоскости.
Кроме того, вторичная структура белка может содержать и другие элементы, такие как повороты, петли и улучшенные структуры α-спирали и β-складки.
Характерные особенности вторичной структуры белка обусловлены их взаимодействием с другими белками, нуклеиновыми кислотами и другими молекулами. Они играют важную роль в пространственной организации белка и определяют его функциональные свойства.
Формирование вторичной структуры
α-спираль образуется благодаря гидрофобным взаимодействиям между аминокислотными остатками, которые образуют продолговатую спиральную структуру. Важную роль в формировании α-спирали играют водородные связи между аминокислотными остатками, которые удерживают структуру в нужной конформации. Эта структура обладает высокой устойчивостью и является ключевым элементом вторичной структуры в большинстве белков.
β-складка представляет собой складывание полипептидной цепи в виде прямых или параллельных цепочек, которые связаны водородными связями между своими аминокислотными остатками. За счет водородных связей и гидрофобных взаимодействий структура становится устойчивой и приобретает определенную форму. В большинстве случаев белок может содержать несколько β-складок, что придает ему специфическую конформацию и функции.
Формирование вторичной структуры белка является следующим шагом после его синтеза и осуществляется постепенно в процессе его складывания. Вторичная структура белка играет важную роль в его функционировании и влияет на его расположение в пространстве.
Роль аминокислот в формировании структуры белка
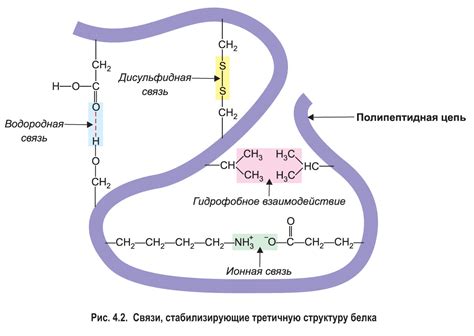
Вторичная структура белка определяется пространственным расположением аминокислот в полипептидной цепи и осуществляется путем образования характерных участков, называемых спиралью α-геликса и страндом β-складки.
Спираль α-геликса образуется за счет водородных связей между аминокислотами в цепочке, которые взаимодействуют друг с другом. Аминокислоты, положение боковых цепей которых способствует их взаимодействию с водой, обычно формируют внешний поверхностный слой спиралевидной структуры.
Странд β-складки состоит из двух или более аминокислотных цепей, которые связываются между собой водородными связями, образуя характерную складку. Для образования странд β-складки важно, чтобы аминокислоты формировали противоположные стороны цепи.
Различные аминокислоты вносят свой вклад в формирование и стабилизацию вторичной структуры белка. Например, аминокислоты с ароматическими циклами, такие как фенилаланин и триптофан, часто образуют гидрофобные взаимодействия и играют важную роль в формировании гидрофобного сердца альфа-спирали. Аминокислоты с полярными боковыми цепями, такие как серин и цистеин, могут образовывать взаимодействия с водой и быть расположены на внешней поверхности структуры.
Таким образом, разнообразие аминокислотных остатков в полипептидной цепи белка определяет его вторичную структуру и влияет на его функциональность. Понимание роли аминокислот в формировании вторичной структуры белка является важным шагом в изучении и понимании белковой биологии в целом.
Влияние вторичной структуры на функциональность белка
Вторичная структура белка, такая как α-спираль, β-складка или терциарная структура, играют важную роль в его функциональности. Вторичная структура определяется последовательностью аминокислотных остатков в белке и образуется благодаря водородным связям между остатками.
Основная функция белка заключается в его способности связываться с другими молекулами, выполнении катализа химических реакций или передаче сигналов. Вторичная структура белка поддерживает его трехмерную конформацию и позволяет белку взаимодействовать с другими молекулами, такими как лиганды или другие белки.
Например, α-спираль обеспечивает белку гибкость и стабильность и может играть роль в связывании субстратов или других компонентов. Бета-складка, с другой стороны, может образовывать прочные структуры и участвовать в белковых связях.
Также, вторичная структура белка может быть важной для его устойчивости к факторам окружающей среды, таким как температура, pH или наличие растворителей. Изменения во вторичной структуре белка могут привести к его денатурации и потере функциональности.
В целом, вторичная структура белка играет важную роль в его функциональности, определяя его способность связываться с другими молекулами и поддерживая его трехмерную конформацию. Понимание вторичной структуры белка помогает увеличить наше знание о его функциях и взаимодействиях в организме.