Химическая природа вещества – это основные свойства и характеристики, которые определяют его способность реагировать с другими веществами. Все вещества состоят из атомов, молекул и ионов, которые взаимодействуют друг с другом и создают различные химические связи. Эти связи и взаимодействия обуславливают разнообразные физические и химические свойства вещества.
Свойства вещества - это его характеристики, которые можно измерить или наблюдать. Они включают такие параметры, как плотность, температуру плавления и кипения, растворимость в различных средах, химическую активность и многие другие. Все эти свойства определяются химической природой вещества и его структурой.
Например, кислоты имеют коррозивные свойства, поскольку они способны реагировать с материалами и вызывать их разрушение. Наоборот, щелочи обладают щелочными свойствами и могут использоваться для нейтрализации кислот. Углеводороды, такие как бензин или масло, являются горючими веществами, потому что они горят при соприкосновении с огнем.
Таким образом, химическая природа вещества определяет его свойства и поведение в различных условиях. Изучение химической природы вещества важно для понимания его взаимодействия с другими веществами, а также для разработки новых материалов с нужными свойствами и характеристиками.
Химическая природа вещества: основные понятия и принципы

Атом - это наименьшая единица химического элемента, которая сохраняет его химические свойства. Элементы - это вещества, состоящие из однородных атомов. Каждый элемент имеет свой уникальный символ и атомный номер. Соединения - это вещества, состоящие из двух или более различных элементов, связанных химическими связями. Реакции - это превращения вещества из одной формы в другую, сопровождающиеся изменением атомного и молекулярного состава.
Химическая природа вещества определяет его физико-химические свойства, такие как температура плавления, теплопроводность, растворимость, активность, электропроводность и другие. Она также определяет возможность взаимодействия вещества с другими веществами и его реакционную способность.
Понимание химической природы вещества позволяет нам лучше понять и объяснить множество процессов и явлений, происходящих в нашей окружающей среде, и применять эти знания в различных областях науки и технологии, включая медицину, пищевую промышленность, энергетику, материаловедение и другие.
Молекулы и атомы: строительные блоки вещества
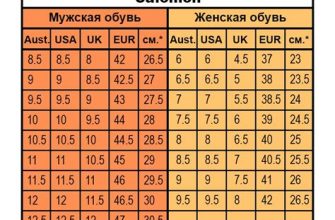
Атом является основной частицей элемента. Он состоит из ядра, в котором находятся протоны и нейтроны, а также облака электронов, движущихся вокруг ядра.
Молекулы и атомы обладают различными химическими свойствами, которые определяют поведение вещества. Эти свойства зависят от числа, расположения и типов атомов, а также от химических связей между ними.
Например, водяной пар состоит из молекул воды, каждая из которых состоит из двух атомов водорода и одного атома кислорода. Благодаря особым свойствам этих атомов и связей между ними, вода легко превращается из жидкого состояния в пар, что делает ее полезной в качестве парового двигателя.
Таким образом, знание о строительных блоках вещества - молекулах и атомах - позволяет лучше понять химическую природу вещей и их свойства, а также прогнозировать и управлять их поведением.
Интермолекулярные силы: силы притяжения между молекулами
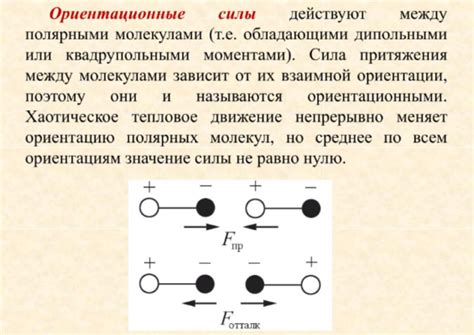
Химические вещества состоят из молекул, которые обладают определенными свойствами. Молекулы взаимодействуют друг с другом благодаря интермолекулярным силам. Интермолекулярные силы представляют собой силы притяжения, действующие между молекулами и определяющие множество свойств вещества.
Существует несколько типов интермолекулярных сил, которые различаются по своей природе и интенсивности. Лондоновские силы, или дисперсионные силы, являются наиболее слабыми интермолекулярными силами. Они возникают в результате временного образования между молекулами моментальных диполей и создают временные неравномерности в распределении электрического заряда. Чем больше атом или молекула, тем сильнее лондоновские силы.
Диполь-дипольные силы возникают у молекул, в которых существуют постоянные или почти постоянные дипольные моменты. Положительные края одних молекул притягивают отрицательные края других молекул. Такие силы взаимодействия устойчивы и более сильны, чем лондоновские силы.
Водородные связи – особый тип диполь-дипольных сил, которые возникают между атомами водорода с высокоэлектроотрицательными атомами, такими как кислород, азот или фтор. Водородные связи являются наиболее сильными интермолекулярными силами и играют важную роль во многих свойствах воды и других веществ.
Интермолекулярные силы определяют точку кипения, температуру плавления, растворимость и другие физические свойства веществ. Они также играют важную роль в химических реакциях и образовании кристаллических структур. Понимание и изучение интермолекулярных сил помогает нам лучше понять природу вещества и его свойства.
Химические связи: ключевой фактор при образовании вещества
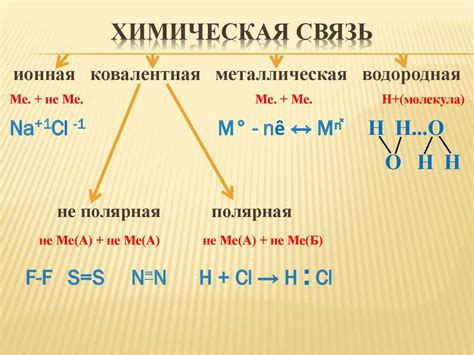
Существует несколько типов химических связей, каждая из которых характеризуется своими особенностями. Ионная связь возникает между атомами с разной электроотрицательностью. Один атом отдает электрон, становясь положительным ионом, а другой атом принимает электрон, становясь отрицательным ионом. Ковалентная связь возникает при обмене или совместном использовании электронов между атомами. В металлической связи электроны между атомами совместно используются и образуют облако электронов.
Различные свойства вещества, такие как температура плавления и кипения, твердотельная структура, растворимость и возможность проводить электрический ток, зависят от типа и силы химических связей вещества. Например, вещества с ионными связями имеют высокую температуру плавления и обладают хорошей растворимостью в воде. Вещества с ковалентными связями могут формировать сложные трехмерные структуры и иметь низкую температуру плавления и кипения.
Химические связи играют ключевую роль в понимании и изучении химических реакций, так как происходит изменение или образование новых связей между атомами и молекулами. Понимание химических связей позволяет предсказывать результаты реакций и создавать новые вещества с желаемыми свойствами.
Электронная структура: определяющий фактор для свойств вещей

Электроны, являющиеся основными носителями заряда, занимают различные энергетические уровни в атоме или молекуле. Распределение электронов по уровням определяется их энергией и принципом заполнения. В результате образуется электронная оболочка, состоящая из внутренних, заполненных уровней и внешней, неполностью заполненной уровнем валентности.
Это распределение электронов играет важную роль в объяснении химической активности и других свойств вещества. Например, количество электронов на внешнем уровне валентности определяет способность атома образовывать химические связи и взаимодействовать с другими атомами. Атомы с полностью заполненной валентной оболочкой имеют малую склонность к химическим реакциям и обычно являются инертными газами.
Кроме того, электронная структура вещества влияет на его физические свойства, такие как теплопроводность, электропроводность, и оптические свойства. Например, вещества с полностью заполненной валентной оболочкой обладают плохой электрической проводимостью, тогда как вещества с неполностью заполненной оболочкой могут быть хорошими проводниками.
Таким образом, понимание и изучение электронной структуры вещества позволяет предсказывать и объяснять его свойства. Это важное понятие используется во многих областях науки и технологии, от химии и физики до материаловедения и биологии.
Химические реакции: процессы превращения вещества

Химические реакции могут происходить с различной интенсивностью и под разными условиями. Некоторые реакции могут происходить мгновенно и сопровождаться видимыми изменениями: появлением газов, изменением цвета или выделением тепла. Другие реакции могут быть медленными и происходить незаметно.
Важными понятиями в химических реакциях являются исходные вещества, или реагенты, и продукты реакции. Реагенты – это вещества, которые участвуют в реакции и изменяются в ходе нее. Продукты реакции – это вещества, которые образуются в результате реакции.
Процессы превращения вещества могут быть обратимыми и необратимыми. Обратимая реакция – это реакция, которая может протекать в обоих направлениях, при определенных условиях вещество может возвращаться в исходное состояние. Необратимая реакция – это реакция, которая может протекать только в одном конкретном направлении.
Химические реакции классифицируются по типу превращения вещества. Важные типы реакций включают синтез, разложение, замещение и окисление-восстановление. В синтезе несколько реагентов соединяются, образуя новое вещество. В разложении одно вещество распадается на два или более продуктов реакции. В замещении один элемент замещается другим в химическом соединении. В окислительно-восстановительной реакции происходит передача электронов.
Химические реакции имеют большое значение в нашей жизни. Они являются основой для процессов синтеза и деструкции веществ. Благодаря химическим реакциям происходит создание новых материалов, производство энергии, образование пищеварительных ферментов и многое другое.
Изучение химических реакций позволяет понять, как происходят процессы изменения вещества в природе и в лабораторных условиях. Кроме того, понимание химических реакций помогает прогнозировать результаты их проведения и разрабатывать новые препараты, материалы и технологии.
Классификация веществ: основные типы и их свойства
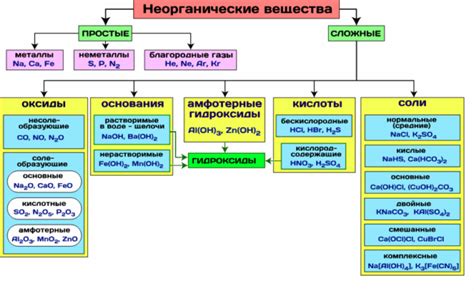
Органические вещества содержат углерод и представляют собой основу жизни на Земле. Они включают органические соединения, такие как углеводы, белки, жиры и нуклеиновые кислоты. Органические вещества обладают сложной структурой и широким спектром свойств. Они могут быть твердыми, жидкими или газообразными при комнатной температуре и давлении.
Неорганические вещества не содержат углерод и включают минералы, металлы и неметаллы. Они обладают более простой структурой и обычно имеют более ограниченный набор свойств. Например, многие неорганические вещества являются твердыми и имеют высокую плотность.
Классификация вещества также может осуществляться на основе силы взаимодействия между его молекулами или атомами. Вещества могут быть классифицированы как молекулярные, ионные или атомарные.
| Тип вещества | Примеры | Свойства |
|---|---|---|
| Молекулярные | вода (H2O), алкоголь, углекислый газ (CO2) | низкие температуры плавления и кипения, слабые электролитические свойства |
| Ионные | соль (NaCl), кислоты, основания | высокая температура плавления и кипения, сильные электролитические свойства |
| Атомарные | гелий (He), неон (Ne), аргон (Ar) | очень низкие температуры плавления и кипения, инертность |
Таким образом, классификация веществ по их типам дает нам понимание основных свойств их структуры и поведения, что существенно сказывается на их применении и влияет на множество аспектов нашей жизни.
Физические и химические свойства: как химическая природа влияет на внешние проявления вещества
Химические свойства вещества – это его способность взаимодействовать с другими веществами и претерпевать химические реакции. Они определяются химической структурой вещества и его атомной или молекулярной композицией. Химические свойства включают в себя реакционную способность, окислительно-восстановительные свойства, кислотность или щелочность и другие химические характеристики.
Именно благодаря своей химической природе вещество проявляет свои физические и химические свойства. Например, молекула воды состоит из атомов кислорода и водорода, и именно благодаря этой химической структуре вода обладает такими свойствами, как жидкое состояние при комнатной температуре, прозрачность, низкое пламя горения и способность растворять множество веществ.
Знание химической природы вещества позволяет предсказывать и понимать его физические и химические свойства, что является основой для разработки новых материалов, лекарств, косметических средств и других продуктов. Открытие и изучение новых химических соединений и их свойств является важной задачей в современной химии и науке в целом.
| Физические свойства | Химические свойства |
|---|---|
| Плотность | Реакционная способность |
| Температура плавления и кипения | Окислительно-восстановительные свойства |
| Теплоемкость | Кислотность или щелочность |
| Проводимость тепла и электричества | и другие... |
Применение знания о химической природе вещества в науке и промышленности

Знание о химической природе вещества играет важную роль в науке и промышленности, позволяя нам понять и использовать свойства вещей в различных сферах жизни.
В научных исследованиях химическая природа вещества помогает ученым исследовать структуру и свойства различных материалов. К примеру, понимание атомной и молекулярной структуры вещества позволяет разрабатывать новые материалы с уникальными свойствами, такие как твердые или жидкие кристаллы, полимеры и металлы. Эти материалы находят применение в различных областях, включая производство электроники, лекарств, строительных материалов и многое другое.
В промышленности знание о химической природе вещества используется для разработки и производства различных продуктов и материалов. Например, ученый-химик может изучать свойства и реакционную способность вещества, чтобы определить его применимость в производстве лекарств, порошков и косметических продуктов. Кроме того, химические процессы, такие как синтез органических соединений или разложение неорганических веществ, используются для получения продуктов с определенными химическими и физическими свойствами.
Использование знания о химической природе вещества также применяется в экологических исследованиях, в которых изучаются последствия промышленных процессов на окружающую среду. Ученые анализируют химические реакции и связи веществ в природе, чтобы понять, какие вещества способны вызывать загрязнение и как их можно устранить или минимизировать.
В целом, знание о химической природе вещества играет центральную роль в развитии науки и промышленности. Оно позволяет нам создавать новые материалы и продукты, улучшать существующие технологии и экологические стандарты, а также лучше понимать и улучшать мир вокруг нас.