Степень диссоциации кислоты - это важный показатель, который характеризует, насколько большая часть молекул кислоты разлагается на ионы в растворе. Она выражается в процентах или в виде безразмерной величины и позволяет определить молекулярную активность кислотного соединения. Высокая степень диссоциации указывает на то, что кислота существенно разлагается в растворе, а низкая степень диссоциации говорит о том, что часть молекул кислоты остается нераспавшейся.
Степень диссоциации кислоты можно определить экспериментальным путем, например, путем измерения pH раствора. Чем ниже значение pH, тем больше диссоциированных ионов кислоты присутствует в растворе, и тем выше степень диссоциации. При этом стоит отметить, что степень диссоциации кислоты может зависеть от различных факторов, таких как концентрация раствора, температура и наличие других веществ.
Значение степени диссоциации кислоты составляет 25%, что означает, что при диссоциации кислоты в растворе каждая четвертая молекула разлагается на ионы. Это свидетельствует о сравнительно низкой активности данной кислоты в растворе. Такая информация может быть полезной при проведении химических реакций, где требуется знание активности кислоты и ее способности реагировать с другими веществами.
Понимание степени диссоциации кислоты является важным для химиков и научных исследователей, поскольку она позволяет понять, какое количество диссоциированных ионов кислоты присутствует в растворе. Это в свою очередь может влиять на множество процессов и реакций, особенно в области катализа и образования соединений. Поэтому измерение и понимание степени диссоциации кислоты является важным компонентом химических исследований и практического применения.
Что такое степень диссоциации кислоты?

Для определения степени диссоциации кислоты необходимо знать концентрации ионов кислоты и общей концентрации кислоты в растворе. Степень диссоциации обычно выражается в процентах и может плавать от 0 до 100. Если кислота полностью диссоциирует, то степень диссоциации будет равна 100%.
Степень диссоциации (α) кислоты может быть определена с помощью уравнения:
| [А]р | = | α × [А]0 |
| [НА] |
где [А]р – концентрация диссоциированного вещества, [А]0 – начальная концентрация вещества (кислоты) и [НА] – концентрация недиссоциированного вещества.
Знание степени диссоциации кислоты важно для понимания ее свойств и реакций. Более высокая степень диссоциации свидетельствует о более сильной кислотности и более интенсивном протекании реакций.
Объяснение и значение

Степень диссоциации кислоты указывает на то, насколько хорошо кислота распадается на ионы в растворе. Она представляет собой коэффициент диссоциации и обозначается α. Если α = 1, то кислота полностью диссоциирована и все молекулы распались на ионы. Если α
Степень диссоциации кислоты имеет важное значение в химии, поскольку она позволяет определить активность кислоты в реакции. Чем выше степень диссоциации, тем активнее кислота и больше ионов она образует в растворе. Это может быть полезно при расчетах реакций, а также при определении кислотности раствора.
| Степень диссоциации | Значение α | Интерпретация |
|---|---|---|
| 0 | 0 | Полное отсутствие диссоциации |
| 0,25 | 0,25 | Частичная диссоциация |
| 0,5 | 0,5 | Умеренная диссоциация |
| 0,75 | 0,75 | Высокая диссоциация |
| 1 | 1 | Полная диссоциация |
Из значений степени диссоциации можно сделать вывод о том, насколько активно кислота будет взаимодействовать с другими реагентами. Чем выше степень диссоциации, тем более активной будет кислота, и наоборот.
Процесс диссоциации кислоты

Степень диссоциации кислоты, также известная как ее диссоциационная константа, определяется как соотношение концентрации диссоциированных ионов кислоты к концентрации недиссоциированной кислоты в растворе. В данном случае степень диссоциации кислоты равна 25, что означает, что 25% кислоты диссоциировали в растворе, а остальные 75% остались недиссоциированными.
Процесс диссоциации кислоты наличествует в абсолютно всех кислотных растворах. Он играет важную роль в химических реакциях и может влиять на различные физические и химические свойства растворов, такие как кислотность, электропроводность и реакционная способность.
Диссоциация кислоты может происходить как полностью, так и частично. В зависимости от специфических условий, некоторые кислоты могут диссоциировать только частично. Степень диссоциации может также зависеть от концентрации кислоты в растворе и температуры.
Процесс диссоциации кислоты является важным аспектом в химии и имеет широкий спектр применений в различных отраслях, от медицины до технологии и промышленности.
Как рассчитать степень диссоциации?

Формула для рассчета степени диссоциации (α) выглядит следующим образом:
| α | = | (концентрация ионов после диссоциации) | / | (начальная концентрация кислоты) |
|---|
Для примера, рассмотрим кислоту HA, которая диссоциирует в воде, образуя ионы H+ и A-. Если начальная концентрация кислоты HA составляет 0,1 М, а после диссоциации в растворе находится 0,02 М ионов H+, то степень диссоциации (α) можно рассчитать по формуле:
| α | = | 0,02 М | / | 0,1 М |
|---|
Подставляя значения в формулу, получим:
| α | = | 0,2 |
|---|
Таким образом, степень диссоциации кислоты HA составляет 0,2 или 20%.
Рассчитав степень диссоциации, можно оценить, насколько полная или неполная диссоциация происходит в растворе. Чем ближе значение степени диссоциации к 1, тем больше кислота диссоциировала.
Факторы, влияющие на степень диссоциации

Степень диссоциации кислоты, также известная как коэффициент диссоциации, определяет долю молекул кислоты, которая распалась на ионы в растворе. Степень диссоциации зависит от нескольких факторов:
| Фактор | Описание |
|---|---|
| Концентрация кислоты | Чем выше концентрация кислоты, тем выше степень диссоциации. Более высокая концентрация кислоты означает больше молекул, которые могут разлагаться на ионы. |
| Ионизация вещества | Некоторые кислоты легче диссоциируются, чем другие. Например, сильные кислоты, такие как серная кислота, диссоциируют в большей степени, чем слабые кислоты, такие как уксусная кислота. Ионизация вещества зависит от его химической структуры и силы связей в молекуле. |
| Температура | Повышение температуры обычно увеличивает степень диссоциации кислоты. Это связано с тем, что при повышении температуры возрастает энергия молекул, что способствует их разлому на ионы. |
| Присутствие ингредиентов | Некоторые вещества могут влиять на степень диссоциации кислоты. Например, добавление соли может уменьшить степень диссоциации, поскольку ионы соли могут связываться с ионами кислоты и предотвращать их разлом. |
Понимание этих факторов позволяет более точно предсказывать и контролировать степень диссоциации кислот в различных условиях. Это имеет значение во многих областях, включая химическую промышленность, фармацевтику и науку.
Значение степени диссоциации

Значение степени диссоциации важно для определения активности и силы кислоты. Чем выше значение степени диссоциации, тем сильнее кислота и тем больше ионов она образует в растворе. Значение степени диссоциации может быть важным параметром при проведении химических реакций или при расчете физико-химических свойств растворов.
Для расчета степени диссоциации можно использовать равенство:
| Степень диссоциации | = | концентрация ионов | / | общая концентрация кислоты |
|---|
Примером значений степени диссоциации может быть значение 0,25, что означает, что 25% молекул кислоты распались на ионы. Важно отметить, что степень диссоциации может быть меньше 1, что означает, что не все молекулы кислоты в растворе распались.
Значение степени диссоциации также зависит от условий, в частности от температуры и концентрации раствора. Увеличение концентрации кислоты или повышение температуры может привести к увеличению степени диссоциации.
Примеры реакций диссоциации кислот
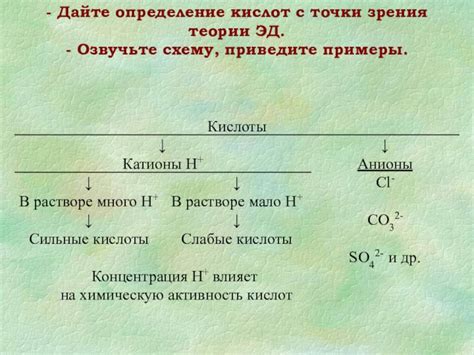
Когда кислоты растворяются в воде, они могут диссоциировать на ионы водорода (H+) и отрицательные ионы аниона. Вот некоторые примеры реакций диссоциации кислот:
- Соляная кислота (HCl): HCl → H+ + Cl-
- Азотная кислота (HNO3): HNO3 → H+ + NO3-
- Серная кислота (H2SO4): H2SO4 → 2H+ + SO4^2-
- Фосфорная кислота (H3PO4): H3PO4 → 3H+ + PO4^3-
- CH3COOH → H+ + CH3COO-
Во всех этих реакциях кислотные молекулы расщепляются на положительные ионы водорода и отрицательные ионы аниона. Эти ионы свободно перемещаются в растворе и могут взаимодействовать с другими ионами или молекулами.
Практическое применение степени диссоциации

| Область применения | Значение |
|---|---|
| Химический анализ | С использованием степени диссоциации кислоты можно определить ее концентрацию в растворе. Это особенно важно при проведении титрования, где точное знание концентрации кислоты позволяет рассчитать необходимое количество реагента для полного протекания реакции. |
| Процессы растворения | Степень диссоциации кислоты позволяет оценить скорость и эффективность процесса растворения. Чем выше степень диссоциации, тем быстрее происходит процесс ионизации кислоты в растворе. |
| Кислотно-щелочные реакции | Степень диссоциации кислоты определяет ее силу и способность реагировать с основаниями. Чем выше степень диссоциации, тем сильнее кислота и тем больше ионов в растворе, готовых к реакции с основанием. |
| Плазменная химия | В медицинской практике степень диссоциации кислот используется для оценки внутренней среды организма, в том числе в плазме крови. Это позволяет контролировать газообмен, уровень pH и электролитный баланс организма. |
Таким образом, степень диссоциации кислоты имеет широкий спектр практического применения и важна для понимания и контроля химических процессов в различных областях.